Fluorid selenový
| Fluorid selenový | |
|---|---|
 Strukturní vzorec | |
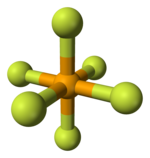 Model molekuly | |
| Obecné | |
| Systematický název | Fluorid selenový, hexafluorid selenu |
| Anglický název | selenium hexafluoride selenium(VI) fluoride selenium fluoride |
| Německý název | Selenhexafluorid |
| Sumární vzorec | SeF6 |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 7783-79-1 |
| Číslo RTECS | VS9450000 |
| Vlastnosti | |
| Molární hmotnost | 192,953 4 g/mol |
| Teplota tání | −34,6 °C[1] |
| Teplota varu | sublimace: −46,6 °C; 226,6 K |
| Hustota | 7,887 kg/m3 |
| Index lomu | 1,895 |
| Rozpustnost ve vodě | nerozpustný |
| Struktura | |
| Krystalová struktura | kosočtverečná |
| Koordinační geometrie | oktaedrická |
| Dipólový moment | nulový |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | 1 030 kJ/mol[1] |
| Bezpečnost | |
 GHS04  GHS05  GHS06 Nebezpečí[2] | |
| NFPA 704 |  0 3 0 |
Některá data mohou pocházet z datové položky. | |
Fluorid selenový (též hexafluorid selenu) je anorganická sloučenina se vzorcem SeF6. Jedná se o bezbarvý plyn, který má odporný zápach.[3]
Běžně se s ním nesetkáváme a rovněž nemá žádné praktické použití.[4]
Struktura, příprava a reakce
Struktura
Stejně jako mnoho ostatních sloučenin selenu, je také fluorid selenový hypervalentní. Má oktaedrický tvar molekuly s vazbou Se–F dlouhou 168,8 pm.
Příprava
SeF6 může být připraven buď přímým slučováním prvků[5]:
Se + 3 F2 → SeF6, nebo reakcí fluoridu bromitého s oxidem seleničitým:
Br2F6 + SeO2 → SeF6 + Br2 + O2.
Reaktivita
Reaktivita hexafluoridů chalkogenů klesá v pořadí TeF6 > SeF6 > SF6, přičemž nejméně reaktivní SF6 je v podstatě inertní vůči hydrolýze při vysokých teplotách, SeF6 také odolává hydrolýze[1] a plynný může projít 10% roztokem NaOH nebo KOH beze změny, ovšem reaguje s plynným amoniakem při 200 °C.[6]
Bezpečnost
Fluorid selenový je toxický již při malých koncentracích.[7]
Ve Spojených státech amerických byl stanovena nejvyšší přípustná koncentrace SeF6 ve vzduchu na hodnotu 0,05 ppm v průměru za osmihodinovou pracovní směnu.
Reference
V tomto článku byl použit překlad textu z článku Selenium hexafluoride na anglické Wikipedii.
- ↑ a b c Inorganic Chemistry,Egon Wiberg, Arnold Frederick Holleman Elsevier 2001 ISBN 0-12-352651-5
- ↑ a b Selenium hexafluoride. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ Material Safety [online]. [cit. 2010-07-24]. Dostupné v archivu pořízeném dne 2012-03-05. Je zde použita šablona
{{Cite web}}označená jako k „pouze dočasnému použití“. - ↑ Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, Weinheim DOI:10.1002/14356007.a23_525Je zde použita šablona
{{DOI}}označená jako k „pouze dočasnému použití“. - ↑ YOST, Don M.; SIMONS, J. H. Sulfur, Selenium, and Tellurium Hexafluorides. Redakce Harold Simmons Booth. Inorganic Syntheses, Volume 1. 1939, s. 121–122. DOI 10.1002/9780470132326.ch44. Je zde použita šablona
{{Cite journal}}označená jako k „pouze dočasnému použití“. - ↑ Krebs B, Bonmann S, Eidenschink I. Selenium-Inorganic Chemistry Encyclopedia of Inorganic Chemistry Ed. R. Bruce King (1994) John wiley & Sons ISBN 0-471-93620-0
- ↑ Medical Management Guidelines for Selenium Hexafluoride (SeF6) [online]. [cit. 2010-07-24]. Dostupné online. Je zde použita šablona
{{Cite web}}označená jako k „pouze dočasnému použití“.
Externí odkazy
 Obrázky, zvuky či videa k tématu Fluorid selenový na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluorid selenový na Wikimedia Commons
 | Tento článek je příliš stručný nebo postrádá důležité informace. Pomozte Wikipedii tím, že jej vhodně rozšíříte. Nevkládejte však bez oprávnění cizí texty. |
| Fluoridy s prvkem v oxidačním čísle VI. | |
|---|---|
| Fluorid americiový (AmF6) • Fluorid zlatový (AuF6) • Fluorid curiový (CmF6) • Fluorid chromový (CrF6) • Fluorid einsteiniový (EsF6) • Fluorid iridiový (IrF6) • Fluorid kryptonový (KrF6) • Fluorid molybdenový (MoF6) • Fluorid neptuniový (NpF6) • Fluorid osmiový (OsF6) • Fluorid palladiový (PdF6) • Fluorid poloniový (PoF6) • Fluorid platinový (PtF6) • Fluorid plutoniový (PuF6) • Fluorid rheniový (ReF6) • Fluorid rhodiový (RhF6) • Fluorid radonový (RnF6) • Fluorid rutheniový (RuF6) • Fluorid sírový (SF6) • Dekafluorid disíry (S2F10) • Fluorid selenový (SeF6) • Fluorid techneciový (TcF6) • Fluorid tellurový (TeF6) • Fluorid uranový (UF6) • Fluorid wolframový (WF6) • Fluorid xenonový (XeF6) | |









