Carbure de tantale
| Carbure de tantale | |||
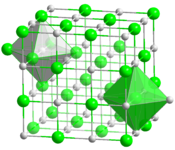 __ Ta4+ __ C4− Maille cristalline du carbure de tantale (TaC, stœchiométrique) | |||
| Identification | |||
|---|---|---|---|
| No CAS | 12070-06-3 (TaC) 12070-07-4 (Ta2C) | ||
| No ECHA | 100.031.914 | ||
| No CE | 235-118-3 (TaC) 235-119-9 (Ta2C) | ||
| Apparence | poudre gris-brun sombre inodore | ||
| Propriétés chimiques | |||
| Formule | CTaTaC | ||
| Masse molaire[1] | 192,958 6 ± 0,000 8 g/mol C 6,22 %, Ta 93,78 %, | ||
| Propriétés physiques | |||
| T° fusion | 3 880 °C (TaC)[2],[3] 3 327 °C (Ta2C)[3] | ||
| T° ébullition | 4 780 °C (TaC)[3] | ||
| Solubilité | insoluble dans l'eau, soluble dans un mélange HF-HNO3[3] | ||
| Précautions | |||
| SGH[2] | |||
 Attention H228 : Matière solide inflammable P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P240 : Mise à la terre/liaison équipotentielle du récipient et du matériel de réception. P241 : Utiliser du matériel électrique/de ventilation/d’éclairage/…/antidéflagrant. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. | |||
| Transport[2] | |||
Numéro ONU : 3178 : SOLIDE INORGANIQUE INFLAMMABLE, N.S.A. Classe : 4.1 Étiquette :  4.1 : Matières solides inflammables, matières autoréactives, matières solides explosibles désensibilisées et matières qui polymérisent Emballage : Groupe d'emballage III : matières faiblement dangereuses. | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Le carbure de tantale est un composé binaire de carbone et de tantale ayant pour formule chimique générique TaCx, où x est généralement compris entre 0,4 et 1. Il y a donc en fait toute une famille de carbures de tantale : x = 0.5 correspond au carbure de tantale(II) Ta2C, encore appelé monocarbure de ditantale, tandis que x = 1 correspond au carbure de tantale(IV).
Le carbure de tantale est essentiellement un produit industriel utilisé pour ses propriétés mécaniques, mais il existe aussi à l'état naturel, sous la forme du minéral rare tantalcarbide, de composition stœchiométrique TaC.
Propriétés
Les carbures de tantale sont des céramiques ultraréfractaires extrêmement dures et cassantes dotées d'une conductivité électrique de type métallique.
La température de fusion des carbures de tantale atteint un maximum aux environs de 3 880 °C en fonction des conditions de mesure et de la pureté des échantillons. Cette valeur est parmi les plus élevées connues pour des composés binaires[4],[5]. Seul le carbure de tantale-hafnium présente une température de fusion sensiblement plus élevée, de l'ordre de 4 215 °C, tandis que la température de fusion du carbure d'hafnium est comparable à celle du carbure de tantale.
Les liaisons entre atomes de carbone et de tantale dans les carbures de tantale sont des mélanges complexes de liaisons ioniques, liaisons métalliques et liaisons covalentes. La forte contribution de ces dernières confère à ces matériaux leur nature très dure et cassante. Le TaC a ainsi une microdureté de 1 600 à 2 000 kg/mm2 (environ 9 sur l'échelle de Mohs) et un module de Young de 285 GPa, alors que les valeurs correspondantes pour le tantale pur sont de 110 kg·mm-2 et 186 GPa.
La dureté, la limite d'élasticité et de contrainte de cisaillement, ainsi que la sensibilité de ces valeurs à la température, augmentent avec le taux x de carbone. TaC est un supraconducteur dont la température critique vaut 10,35 K[6].
Les propriétés magnétiques de TaCx sont diamagnétiques pour x ≤ 0,9 et deviennent paramagnétiques pour x > 0,9. Le carbure d'hafnium présente le comportement inverse bien qu'il partage la même structure cristalline que le carbure de tantale[7].
Carbures de tantale synthétiques
Les carbures de tantale se présentent comme des poudres gris-brun sombres habituellement traitées par frittage. Ce sont des constituants importants de matériaux cermet qui sont employés commercialement dans divers outillages utilisés en découpage des métaux et sont parfois ajoutés aux alliages de carbure de tungstène[8].
On obtient les matériaux de composition TaCx souhaitée à partir d'un mélange de tantale et de graphite pulvérulents chauffé sous vide ou sous atmosphère inerte (argon) à 2 000 °C à l'aide d'un four industriel ou à arc électrique[9],[10].
Un autre procédé consiste à réduire l'oxyde de tantale(V) Ta2O5 par le carbone sous vide ou sous atmosphère d'hydrogène à une température de 1 500 à 1 700 °C ; ce procédé a été utilisé en 1876 pour produire du carbure de tantale, mais ne permet pas de contrôler la stœchiométrie du produit.
Carbure de tantale naturel
Le carbure de tantale naturel est décrit en 1909 par Paul Walther, qui le prend pour du tantale natif. Il est renommé carbure de tantale (tantalum carbide) par Victor Goldschmidt en 1926. Sa composition est vérifiée par Clifford Frondel (de) en 1962. Enfin, Karl Hugo Strunz lui donne en 1966 le nom de tantalcarbide[a].
Sa localité type est le gisement Avrorinsky (rivière Aktaï (en), massif Baranchinsky, Nijni Taguil, oblast de Sverdlovsk, Russie)[11].
Notes et références
Notes
- ↑ On donne aux minéraux des noms spécifiques pour les distinguer des composés chimiques.
Références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c et d Carbure de tantale, page consultée le 13 octobre 2013 sur le site Alfa Aesar
- ↑ a b c et d (en) Physical Constants of Inorganic Compounds in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86e édition), p. 4-44, CRC Press, Boca Raton, États-Unis. (ISBN 0-8493-0486-5).
- ↑ La valeur de 4 000 °C publiée pour le TaC0,89 ne repose pas sur une mesure physique mais sur une extrapolation du diagramme de phase en référence au carbure de niobium NbC — voir Emeléus à ce sujet.
- ↑ (en) Harry Julius Emeléus, « Advances in Inorganic Chemistry and Radiochemistry », Academic Press (1968), pp. 174–176. (ISBN 978-0-12-023611-4). Consulté le 3 mai 2011.
- ↑ (en) V. Valvoda, « X-ray diffraction study of Debye temperature and charge distribution in tantalum monocarbide », physica status solidi (a), vol. 64, no 1, , p. 133-142 (lire en ligne) DOI 10.1002/pssa.2210640114
- ↑ (en) Aleksandr Ivanovich Gusev, Andreĭ Andreevich Rempel et Andreas J. Magerl, « Disorder and order in strongly nonstoichiometric compounds: transition metal carbides, nitrides, and oxides », Springer (2001), pp. 513–516. (ISBN 978-3-540-41817-7). Consulté le 3 mai 2011.
- ↑ (en) John Emsley, « Nature's building blocks: an A-Z guide to the elements », Oxford University Press (11 August 2003), pp. 421-. (ISBN 978-0-19-850340-8). Consulté le 2 mai 2011.
- ↑ (en) Bertil Lönnberg, Torsten Lundström et Roland Tellgren, « A neutron powder diffraction study of Ta2C and W2C », Journal of the Less Common Metals, vol. 120, no 2, , p. 239-245 (lire en ligne) DOI 10.1016/0022-5088(86)90648-X
- ↑ (en) Erwin RUDY, C. E. BRUKL et Stephan WINDISCH, « Constitution of Ternary Ta-Mo-C Alloys », Journal of the American Ceramic Society, vol. 51, no 5, , p. 239-250 (lire en ligne) DOI 10.1111/j.1151-2916.1968.tb13850.x
- ↑ (en) « Tantalcarbide », sur Mindat.org (consulté le ).
v · m Composés du tantale | |||
|---|---|---|---|
| Ta(II) |
| ||
| Ta(III) |
| ||
| Ta(IV) |
| ||
| Ta(V) |
| ||
v · m | |
|---|---|
 Portail de la chimie
Portail de la chimie  Portail des sciences des matériaux
Portail des sciences des matériaux










