Chlorure de sulfuryle
| Chlorure de sulfuryle | |
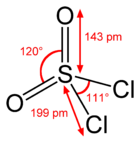  Structure du chlorure de sulfuryle | |
| Identification | |
|---|---|
| Nom UICPA | Chlorure de sulfuryle |
| Synonymes | Chlorure sulfurique |
| No CAS | 7791-25-5 |
| No ECHA | 100.029.314 |
| No CE | 232-245-6 |
| Propriétés chimiques | |
| Formule | Cl2O2SSO2Cl2 |
| Masse molaire[1] | 134,97 ± 0,01 g/mol Cl 52,53 %, O 23,71 %, S 23,76 %, |
| Propriétés physiques | |
| T° fusion | −54,1 °C |
| T° ébullition | 69,4 °C |
| Masse volumique | 1 667 kg·m-3 à 20 °C |
| Précautions | |
| Directive 67/548/EEC | |
 C Numéro index : 016-016-00-6 Symboles : C : Corrosif Phrases R : R14 : Réagit violemment au contact de l’eau. R34 : Provoque des brûlures. R37 : Irritant pour les voies respiratoires. Phrases S : S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste. S45 : En cas d’accident ou de malaise, consulter immédiatement un médecin (si possible, lui montrer l’étiquette). (S1/2) : Conserver sous clef et hors de portée des enfants. Phrases R : 14, 34, 37, Phrases S : (1/2), 26, 45, | |
| Unités du SI et CNTP, sauf indication contraire. | |
modifier  | |
Le chlorure de sulfuryle est un composé inorganique de la famille des oxychlorures, de formule SO2Cl2. Il se présente comme un liquide incolore à odeur piquante. On ne le trouve pas dans la nature, en raison de son hydrolyse très rapide.
On le confond souvent avec le chlorure de thionyle SOCl2, mais ces deux oxychlorures de soufre ont des propriétés différentes : le chlorure de thionyle produit des ions chlorures Cl− tandis que le chlorure de sulfuryle donne du chlore Cl2.
Préparation et réactions
On prépare le chlorure de sulfuryle en faisant réagir du dioxyde de soufre SO2 et du chlore Cl2 en présence d'un catalyseur, tel que du charbon actif :
- SO2 + Cl2 → SO2Cl2.
Le produit obtenu peut ensuite être purifié par distillation fractionnée.
Le chlorure de sulfuryle réagit violemment avec l'eau en libérant du chlorure d'hydrogène HCl et en donnant de l'acide sulfurique H2SO4 :
- 2 H2O + SO2Cl2 → 2 HCl + H2SO4
Il se décompose à la chaleur, vers 100 °C, soit environ 30 °C au-dessus de son point d'ébullition. Il se décompose également lentement à température ambiante pour donner du dioxyde de soufre SO2 et du dichlore Cl2, à l'origine de la légère teinte jaunâtre des échantillons de chlorure de sulfuryle qui ont eu le temps de « vieillir ».
Applications
Dans la mesure où le chlorure de sulfuryle est liquide, on le trouve plus commode à manipuler que le dichlore, qui est gazeux, ce qui fait qu'on l'utilise comme source de chlore facilement transportable, stockable et mesurable. Il est également utilisé pour chlorer alcanes, alcènes, alcynes, arènes et époxydes, selon des réactions radicalaires initiées par l'AIBN. Il peut en outre convertir les alcools en organochlorés.
Dans l'industrie, le chlorure de sulfuryle intervient surtout dans la fabrication de pesticides.
Sécurité
Le chlorure de sulfuryle est un produit toxique, corrosif et lacrymogène. Il est susceptible de former des mélanges explosifs avec l'eau, ainsi qu'avec le diméthylsulfoxyde O=S(CH3)2 (DMSO) et le diméthylformamide OHC–N(CH3)2 (DMF).
Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
v · m | |
|---|---|
| Chlorures Cl(-I) |
|
| Interhalogènes | |
| Composés BCl4, AuCl4 |
|
| Composés AlCl6, PCl6... |
|
| Composés NbCl7, TaCl7 |
|
| Perchlorocarbures |
|
| Hydrocarbures halogénés |
|
| Oxohalogénures | |
 Portail de la chimie
Portail de la chimie










