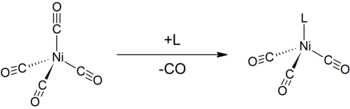Nikel tetrakarbonil
 | |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC Tetrakarbonilnikel | |||
| Nama lain Nikel tetrakarbonil Nikel karbonil | |||
| Penanda | |||
Nomor CAS |
| ||
Model 3D (JSmol) |
| ||
| 3DMet | {{{3DMet}}} | ||
| ChEBI |
| ||
| ChemSpider |
| ||
| Nomor EC | |||
PubChem CID |
| ||
| Nomor RTECS | {{{value}}} | ||
| Nomor UN | 1259 | ||
CompTox Dashboard (EPA) |
| ||
InChI
| |||
SMILES
| |||
| Sifat | |||
Rumus kimia | Ni(CO)4 | ||
| Massa molar | 170,73 g/mol | ||
| Penampilan | Cairan tak berwarna atau kuning sangat pucat[1] diamagnetik | ||
| Bau | apak,[1] seperti debu bata | ||
| Densitas | 1,319 g/cm3 | ||
| Titik lebur | −172 °C (101 K) | ||
| Titik didih | 43 °C (316 K) | ||
Kelarutan dalam air | 0,018 g/100 mL (10 °C) | ||
| Kelarutan | bercampur dalam sebagian besar pelarut organik larut dalam asam nitrat, air raja | ||
| Tekanan uap | 315 mmHg (20 °C)[1] | ||
| Viskositas | 3,05×10−4 Pa•s | ||
| Struktur | |||
| Tetrahedral | |||
| Tetrahedral | |||
| nol | |||
| Termokimia | |||
| Entropi molar standar (S | 320 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH | −632 kJ/mol | ||
| Entalpi pembakaran standar ΔcH | −1180 kJ/mol | ||
| Bahaya | |||
| Lembar data keselamatan | ICSC 0064 | ||
Klasifikasi UE (DSD) (usang) | Mudah terbakar (F) Carc. Cat. 3 Repr. Cat. 2 Sangat beracun (T+) Berbahaya bagi lingkungan (N) | ||
| Frasa-R | R61, R11, R26, R40, R50/53 | ||
| Frasa-S | S53, S45, S60, S61 | ||
| Titik nyala | 4 °C (39 °F; 277 K) | ||
Suhu swasulut | 60 °C (333 K) | ||
| Ambang ledakan | 2–34% | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LC50 (konsentrasi median) | 266 ppm (kucing, 30 min) 35 ppm (kelinci, 30 min) 94 ppm (tikus, 30 min) 10 ppm (tikus, 10 min)[2] | ||
LCLo (terendah tercatat) | 360 ppm (anjing, 90 min) 30 ppm (manusia, 30 min) 42 ppm (kelinci, 30 min) 7 ppm (tikus, 30 min)[2] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan) | TWA 0,001 ppm (0.007 mg/m3)[1] | ||
REL (yang direkomendasikan) | TWA 0,001 ppm (0.007 mg/m3)[1] | ||
IDLH (langsung berbahaya) | Ca [2 ppm][1] | ||
| Senyawa terkait | |||
Related logam karbonil | Besi pentakarbonil Dikobalt oktakarbonil | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
 Y verifikasi (apa ini Y verifikasi (apa ini  Y Y N ?) N ?) | |||
| Referensi | |||
Nikel karbonil (nama IUPAC: tetrakarbonilnikel) adalah senyawa organonikel dengan rumus kimia Ni(CO)4. Cairan berwarna kuning pucat ini adalah karbonil nikel utama. Ini adalah zat antara dalam proses Mond untuk pemurnian nikel dan pereaksi di kimia organologam. Nikel karbonil adalah salah satu zat paling beracun yang ditemui dalam proses industri.[3]
Struktur dan ikatan
Pada nikel tetrakarbonil, bilangan oksidasi untuk nikel adalah nol. Rumusnya sesuai dengan aturan 18-elektron. Molekulnya adalah tetrahedral, dengan empat ligan karbonil (karbon monoksida) yang menempel pada nikel. Ligan CO, di mana C dan O dihubungkan oleh ikatan rangkap tiga, berikatan kovalen dengan atom nikel melalui atom karbon. Telah dilakukan studi difraksi elektron pada molekul ini, dan jarak Ni–C dan C–O telah dihitung masing-masing adalah 1,838(2) dan 1,141(2) angstrom.[4]
Preparasi
Ni(CO)4 pertama kali disintesis pada tahun 1890 oleh Ludwig Mond melalui reaksi langsung logam nikel dengan CO.[5] Karya rintisan ini meramalkan adanya banyak senyawa karbonil logam lainnya, termasuk karbonil V, Cr, Mn, Fe, dan Co. Hal itu juga diterapkan oleh industri untuk pemurnian nikel pada akhir abad ke-19.[6]
Karbon monoksida dilewatkan melalui nikel tak murni pada 323 K (50 °C; 122 °F). Tingkat optimal terjadi pada 130 °C.[7]
Ni(CO)4 tidak tersedia secara komersial. Ini mudah dihasilkan di laboratorium melalui karbonilasi bis(siklooktadiena)nikel(0) yang tersedia secara komersial.[8]
Reaksi

Dekarbonilasi termal
Pada pemanasan sedang, Ni(CO)4 terdekomposisi menjadi karbon monoksida dan logam nikel. Dikombinasikan dengan mudahnya pembentukan dari CO dan nikel tak murni sekalipun, dekomposisi ini menjadi dasar proses Mond untuk pemurnian nikel. Dekomposisi termal dimulai mendekati 180 °C dan meningkat pada suhu yang lebih tinggi.[7]
Reaksi dengan nukleofil dan reduktor
Seperti karbonil logam valensi rendah lainnya, Ni(CO)4 rentan diserang oleh nukleofil. Serangan dapat terjadi di pusat nikel (atau pada CO), mengakibatkan perpindahan ligan CO. Jadi, ligan donor seperti trifenilfosfin bereaksi membentuk Ni(CO) dan Ni(CO). Bipiridin dan ligan terkait juga berperilaku sama.[9] Monosubstitusi nikel tetrakarbonil dengan ligan lainnya dapat digunakan untuk menentukan parameter elektronik Tolman, ukuran kemampuan ligan yang diberikan untuk menyumbangkan atau menarik elektron.
Perlakuan dengan hidroksida menghasilkan kluster seperti [Ni' Too many ('"; dan [Ni' Too many ('";. Senyawa ini juga bisa diperoleh melalui reduksi nikel karbonil.
Dengan demikian, perlakuan Ni(CO) dengan nukleofil karbon (Nu−) menghasilkan derivat asil seperti [Ni(CO)' Too many ('";.[10]
Reaksi dengan elektrofil dan oksidator
Karbonil nikel bisa dioksidasi. Klorin mengoksidasi nikel karbonil menjadi NiCl2, melepaskan gas CO. Halogen lainnya berperilaku serupa. Reaksi ini memberikan metode yang mudah untuk menghancurkan bagian yang tidak diinginkan dari senyawa beracun.
Reaksi Ni(CO)4 dengan alkil dan aril halida sering menghasilkan produk organik terkarbonilasi. Halida vinilik, seperti PhCH=CHBr, dikonversi menjadi ester tak jenuh pada perlakuan dengan Ni(CO)4 yang diikuti dengan natrium methoksida. Reaksi semacam itu juga mungkin berlangsung melalui adisi oksidatif. Halida alilik menghasilkan senyawa π-alilnikel, seperti (allyl)2Ni:[11]
- 2 Ni(CO)4 + 2 ClCH2CH=CH2 → Ni(μ−Cl)2(η3−C + 8 CO
Toksikologi dan pertimbangan keselamatan
Bahaya Ni(CO)4 jauh lebih besar daripada yang tersirat dari kandungan CO-nya, yang mencerminkan efek nikel jika dilepaskan di tubuh. Nikel karbonil bisa berakibat fatal jika diserap melalui kulit, terlebih jika terhirup karena volatilitasnya yang tinggi. Dosis LD50nya untuk paparan 30 menit diperkirakan pada 3 ppm, dan konsentrasi fatal pada manusia adalah 30 ppm. Beberapa subjek yang terpapar uap sampai 5 ppm menggambarkan baunya sebagai apek atau jelaga, namun karena senyawa ini sangat beracun, baunya tidak memberikan peringatan yang memadai terhadap paparan yang berpotensi fatal.[12]
Uap Ni(CO)4 dapat mengalami swasulut. Uap terdekomposisi dengan cepat di udara, dengan waktu paruh sekitar 40 detik.[13]
Keracunan nikel karbonil ditandai dengan sakit dua tahap. Pertama ditandai dari sakit kepala dan nyeri dada yang berlangsung beberapa jam, biasanya diikuti dengan remisi singkat. Fase kedua adalah pneumonitis kimia yang dimulai biasanya setelah 16 jam dengan gejala batuk, sesak napas dan kelelahan ekstrem. Ini mencapai tingkat keparahan tertinggi setelah empat hari, kemungkinan mengakibatkan kematian akibat kardiorespirasi atau gagal ginjal. Konvalesensi sering kali sangat berlarut-larut, sering dipersulit oleh kelelahan, depresi dan dispnea saat beraktivitas. Kerusakan saluran pernafasan permanen adalah tidak biasa. Karsinogenisitas Ni(CO)4 masih diperdebatkan.
Ini diklasifikasikan sebagai bahan yang sangat berbahaya di Amerika Serikat sebagaimana didefinisikan dalam Section 302 dari Emergency Planning and Community Right-to-Know Act AS (42 USC 11002), dan tunduk pada persyaratan pelaporan yang ketat untul fasilitas yang memproduksi, menyimpan, atau menggunakannya dalam jumlah yang signifikan.[14]
Referensi
- ^ a b c d e f "NIOSH Pocket Guide to Chemical Hazards #0444". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Nickel carbonyl". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ The Merck Index (edisi ke-7th). Merck.
- ^ Hedberg, L.; Iijima, T.; Hedberg, K. (1979). "Nickel tetracarbonyl, Ni(CO)4. I. Molecular Structure by Gaseous Electron Diffraction. II. Refinement of Quadratic Force Field". The Journal of Chemical Physics. 70 (7): 3224–3229. doi:10.1063/1.437911.
- ^ Mond, L.; Langer, C.; Quincke, F. (1890). "Action of Carbon Monoxide on Nickel". J. Chem. Soc. Trans. 57: 749–753. doi:10.1039/CT8905700749.
- ^ "The Extraction of Nickel from its Ores by the Mond Process". Nature. 59 (1516): 63–64. 1898. doi:10.1038/059063a0.
- ^ a b Lascelles, K.; Morgan, L. G.; Nicholls, D.; Beyersmann, D. (2005), "Nickel Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a17_235.pub2 Pemeliharaan CS1: Banyak nama: authors list (link)
- ^ Jolly, P. W. (1982). "Nickel Tetracarbonyl". Dalam Abel, Edward W.; Stone, F. Gordon A.; Wilkinson, Geoffrey. Comprehensive Organometallic Chemistry. I. Oxford: Pergamon Press. ISBN 0-08-025269-9.
- ^ Elschenbroich, C.; Salzer, A. (1992). Organometallics: A Concise Introduction (edisi ke-2nd). Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ^ Pinhas, A. R. (2003). "Tetracarbonylnickel". Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rt025m. ISBN 0471936235.
- ^ Semmelhack, M. F.; Helquist, P. M. (1972). "Reaction of Aryl Halides with π-Allylnickel Halides: Methallylbenzene". Org. Synth. 52: 115; Coll. Vol. 6: 722.
- ^ Board on Environmental Studies and Toxicology (2008). "Nickel Carbonyl: Acute Exposure Guideline Levels". Acute Exposure Guideline Levels for Selected Airborne Chemicals. 6. National Academies Press. hlm. 213–259.
- ^ Stedman, D. H.; Hikade, D. A.; Pearson, R., Jr.; Yalvac, E. D. (1980). "Nickel Carbonyl: Decomposition in Air and Related Kinetic Studies". Science. 208 (4447): 1029–1031. doi:10.1126/science.208.4447.1029. PMID 17779026.
- ^ "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities" (PDF) (edisi ke-July 1, 2008). Government Printing Office. Diakses tanggal October 29, 2011.
Bacaan lebih lanjut
- Shi, Z. (1991). "Nickel Carbonyl: Toxicity and Human Health". Science of the Total Environment. 148 (2–3): 293–298. doi:10.1016/0048-9697(94)90406-5. PMID 8029705.
- Sunderman, F. W. (1989). "A Pilgrimage into the Archives of Nickel Toxicology". Annals of Clinical and Laboratory Science. 19 (1): 1–16. PMID 2644888.
- Armit, H. W. (1907). "The Toxicology of Nickel Carbonyl. Part I" (pdf). Journal of Hygiene. 7 (4): 525–551. doi:10.1017/S0022172400033507. PMC 2236193
 . PMID 20474327.
. PMID 20474327. - Armit, H. W. (1908). "The Toxicology of Nickel Carbonyl. Part II" (pdf). Journal of Hygiene. 8 (5): 565–610. doi:10.1017/S0022172400015989. PMC 2167169
 . PMID 20474374.
. PMID 20474374. - Barceloux, D. G.; Barceloux, Donald (1999). "Nickel". Clinical Toxicology. 37 (2): 239–258. doi:10.1081/CLT-100102423. PMID 10382559.
Pranala luar
- (Inggris) International Chemical Safety Card 0064
- (Inggris) National Pollutant Inventory – Nickel carbonyl fact sheet Diarsipkan 2006-08-20 di Wayback Machine.
- (Inggris) NIOSH Pocket Guide to Chemical Hazards
- (Inggris) IARC Monograph "Nickel and Nickel compounds"