Organosiliciumchemie

In de organosiliciumchemie worden organische verbindingen bestudeerd waarin een directe binding optreedt tussen koolstof en silicium.[1][2][3][4] Hierop geldt één uitzondering: siliciumcarbide wordt als een anorganische verbinding beschouwd.
Net als koolstof, waar het in het periodiek systeem in dezelfde groep direct onder staat, heeft organisch gebonden silicium vier bindingen, die net als bij koolstof in principe naar de hoekpunten van een regelmatige tetraëder wijzen. In de biochemie komt de binding tussen koolstof en silicium nauwelijks voor,[5] hoewel er enig bewijs is voor hun bestaan bij sommige groepen zoetwateralgen.[6] De eerste organosiliciumverbinding, tetraethylsilaan, werd in 1863 door Charles Friedel en James Crafts verkregen uit de reactie van tetrachloorsilaan met di-ethylzink.
Organosilanen
De binding tussen koolstof en silicium is, in vergelijking met de binding tussen twee koolstofatomen, langer (186 pm tegenover 154 pm) en zwakker (bindingsenergie: 451 kJ/mol respectievelijk 607 kJ/mol)[7]. De binding tussen koolstof en silicium is iets gepolariseerd, koolstof is elektronegatiever dan silicium (C 2.55 tegen Si 1.90). De polarisatie van de binding blijkt bijvoorbeeld in de Sakurai-reactie. De oxidatieve koppelingsreacties met silicium worden vertegenwoordigd door de Hiyama-koppeling. Sommige alkylsilanen kunnen in de Fleming-Tamao-oxidatie naar alcoholen worden omgezet.
De chemische eigenschappen van silanen, zoals tetramethylsilaan, zijn vergelijkbaar met die van de alkanen (thermische stabiliteit is daarvan een voorbeeld). Het β-silicium effect beschrijft het stabiliserende effect van een siliciumgroep op de β-plaats, de plaats naast een koolstofatoom met een positieve lading. Deze stabilisatie heeft vergaande invloed op de reactiviteit van de verbindingen.
Organische silicium-zuurstofverbindingen
De binding tussen zuurstof en silicium is aanmerkelijk korter en ook sterker dan de binding tussen zuurstof en koolstof (809 in vergelijking tot 538 kJ/mol). Het verschil in elektronegativiteit tussen zuurstof en silicium leidt tot een groter dipoolmoment in de binding. Voorbeelden van organosilicium-zuurstofverbindingen zijn:
- Silylacetalen RR'Si(OR)2,
- silanolen,
- siloxanenen en de polymere siliconen
- silylethers
De silylethers worden uitgebreid toegepast als beschermende groep voor alcoholen. Alleen de binding tussen silicium en fluor is sterker dan die tussen silicium en zuurstof. Fluorideverbindingen als TBAF worden daarom vaak toegepast om de beschermende groep weer te verwijderen. De te boeken energiewinst bij de vorming van de binding tussen silicium en zuurstof wordt in een groot aantal organische reacties als drijvende kracht gebruikt. De Brook-omlegging en de Petersonolefinering zijn voorbeelden van dit type reactie.
Een ander aspect van de veel sterkere binding tussen zuurstof en silicium, vergeleken met de binding tussen zuurstof en koolstof, wordt gevonden in de zeer explosieve silicium analoga Si(CH2ONO2)4 en Si(CH2N3)4 van penta-erytritoltetranitraat:[8][9]
Een enkel kristal van deze verbinding, voor het eerst in 2007 gesynthetiseerd, detoneerde al bij contact met een teflon spatel. Verder onderzoek naar de eigenschappen van de verbinding was daardoor niet meer mogelijk.
Een andere bijdrage aan het exotherme ontledingskarakter van de verbindingen, afgeleid uit veilige in silico-experimenten, is het vermogen van silicium om in de vaste toestand, naast de vier koolstofliganden, ook coördinatieverbindingen aan te gaan met zuurstofatomen van de nitrogroepen. Via deze extra coördinatie wordt de vorming van siliciumdioxide, een van de ontledingsproducten, een stuk makkelijker. Meer stabiele voorbeelden van dit soort siliciumverbindingen worden gevonden in de silatranen.
Silylhalogeniden
Organosilylhalogeniden zijn belangrijke reagentia in de organische chemie, met name trimethylchloorsilaan ( Me3SiCl). De klassieke syntheseroute naar deze groep verbindingen, de Flood reaction, verloopt door verwarming van een reactiemengsel van hexalkyldisiloxaan:[10] R3SiOSiR3, geconcentreerd zwavelzuur en een natriumhalide.[11] Andere belangrijke silylhalogeniden worden gevormd door dichloormethylfenylsilaan, dimethyldichloorsilaan, methyltrichloorsilaan, (4-aminobutyl)di-ethoxymethylsilaan, trichloor(chloormethyl)silaan, trichloor(dichloorfenyl)silaan, trichloorethylsilaan en trichloorfenylsilaan.
Silylhydriden
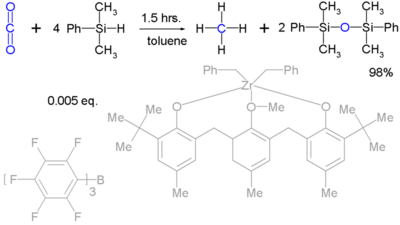
De binding tussen silicium en waterstof is langer dan die tussen koolstof en waterstof (148 vergeleken met 105 pm) en ook zwakker (299 tegenover 338 kJ/mol). Waterstof is elektronegatiever dan silicium dus is volgens de IUPACnaamgevingsregels de correcte naam: siliciumhydride. De stamverbinding, SiH4, wordt silaan genoemd. Een voorbeeld van zo'n verbinding is fenylsilaan, (C6H5)SiH3. Silylhydriden als PMHS zijn erg reactief en ze worden ingezet als reductor.
Met behulp van tri-ethylsilylhydride kunnen fenylazides omgezet worden in anilines:[12]
ACCN is in deze reactie de initiator, een alifatisch thiol zorgt voor de overdracht van het radicaal naar het silylhydride. Het gevormde tri-ethylsilyl-radicaal reageert vervolgens, onder uitstoting van distikstof met het azide tot een N-silylarylaminyl-radicaal, dat op zijn beurt een waterstofatoom onttrekt aan het thiol, waarmee de katalytische cyclus gesloten is:
Via de reactie met water, dat in het vervolg van de reactie gebruikt wordt om bijproducten die in water oplossen uit het reactiemengsel te verwijderen, ontstaat uiteindelijk het aniline.
Silylhydriden zijn zelfs in staat om stabiele moleculen als koolstofdioxide tot methaan te reduceren. Het nadeel van deze reactie is de complexe katalysator die nodig is:[13]
Hydrosilylatie
Met een aantal onverzadigde verbindingen, zoals alkenen, alkynen, imines, carbonylverbindingen en oximen, reageren silylhydriden tot nieuwe organosiliciumverbindingen in een reactie die bekendstaat als hydrosilylatie. In de reactie tussen trifenylsilylhydride en fenylacetyleen is het reactieproduct een mengsel van een geminal vinylsilaan en het trans-isomeer ervan zoals in onderstaande figuur wordt weergegeven:[14]
In de silylmetalering neemt een metaal de plaats van waterstof in.
Sileen
In tegenstelling tot de koolstofchemie, waarin het optreden van de dubbele binding uitgebreid voorkomt, is de dubbele binding in de siliciumchemie niet onbekend, maar ook niet ruim aanwezig. Het optreden van een extra knoopvlak in de silicium 3p-orbitaal maakt de overlap mat de 2p-orbitaal op koolstof minder gunstig en ook het grote verschil in elektronegativiteit speelt het optreden van de dubbele binding tussen koolstof en silicium parten.[15] Wel bestaande verbindingen met zo'n binding, silenen Si=C (of alkylideensilanen) zijn laboratoriumcuriositeiten zoals het silicium analogon van benzeen: silabenzeen. In 1967 werden de eerste bewijzen gevonden voor het bestaan van silenen in de pyrolyse van dimethylsilacyclobutaan.[16] Het eerste stabiele sileen werd in de 1981 beschreven. De stabiliteit van dit sileen is het gevolg van kinetische factoren.[17]

In disilenen treedt een Si=Si dubbele binding op, disilynen zijn de silicium analoga van de alkynen. Het eerste Silyn (met een drievoudige binding tussen koolstof en silicium) werd in 2010 beschreven.[18]
Silool

Silolen, ook aangeduid als silacyclopentadienen, vormen een groep verbindingen waarin een van de koolstofatomen in cyclopentadieen, het verzadigde koolstofatoom, is vervangen door silicium. Ze kunnen ook beschreven worden als het silicium-analogon van pyrool. Momenteel (2010) trekken silolen vooral academische belangstelling in verband met hun elektroluminescentie en andere elektronische eigenschappen.[19][20] Elektronen kunnen zich makkelijk via silolen verplaatsen. Deze eigenschap is het gevolg van een laag-energetische LUMO die ontstaat door interactie tussen een antibindende sigma-orbitaal tussen silicium en koolstof met een antibindende π-orbitaal van het 1,3-butadieengedeelte van het molecuul.
Hypergecoördineerd silicium
Naast de verbindingen met het standaard aantal van vier liganden voor silicium zijn er ook verbindingen bekend waarin meer liganden voorkomen. Fenylsilatraan, met één organoligand en vier heteroatomen als ligand aan silicium, vormt een voorbeeld van de atranen. Het stabiele pentaorganosilicaat is een voorbeeld uit een andere groep hypervalentie organosiliciumverbindingen:[21]
Navigatie Koolstof-elementbinding
Bronnen, noten en/of referenties
|