Stikstofwortelknolletje











Stikstofwortelknolletjes komen voor op de wortels van voornamelijk vlinderbloemige planten en bij de rosids. De wortelknolletjes worden gevormd onder invloed van heterotrofe bacteriën uit onder andere het geslacht Rhizobium, die in deze knolletjes in mutualistische symbiose met de plant leven, de bacil krijgt suiker van de plant. En geeft de plant stikstofverbindingen (waardoor de plant kan groeien en eiwtirijk zal worden). Met behulp van nitrogenase leggen ze voor deze planten stikstof (N2) uit de lucht vast in ammoniak (NH3). De gevormde ammoniak wordt, door andere soorten vrij levende bodembacteriën, via zogeheten nitrificatie verder omgezet in de stikstofverbinding nitraat, die de plant, opgelost in bodemvocht, via zijn wortels kan opnemen. De heterotrofe bacteriën betrekken hun energie uit glucose die de plant tijdens de fotosynthese assimileert. Appelzuur als afbraakproduct van glucose is de directe koolstofbron voor de bacterie. De stikstoffixatie in het wortelknolletje is zeer zuurstofgevoelig. Peulvruchtenwortelknolletjes bevatten het ijzerhoudend eiwit leghemoglobine, nauw verwant aan het dierlijke myoglobine, om de diffusie van zuurstofgas gebruikt bij de ademhaling te vergemakkelijken.
Bij bomen, zoals bij elzen vindt stikstofbinding plaats door de Frankia alni-bacteriën.
Ook bij in de tropen voorkomende Trema-soorten komen Rhizobium-stikstofwortelknolletjes voor.[1]
De aantasting door wortelknobbelaaltjes en wortelgalaaltjes kan veel op stikstofknolletjes lijken.
Het zaaizaad van soja wordt geïnoculeerd met de stikstofbindende bacterie Bradyrhizobium japonicum als deze bacterie van nature niet in de grond aanwezig is, hetgeen het geval is bij de grond in Nederland.
Een hoog stikstofgehalte in de grond remt de ontwikkeling van de wortelknolletjes, omdat de plant er dan geen voordeel van heeft de symbiose aan te gaan.
Reactievergelijkingen
De door nitrogenase gekatalyseerde gesommeerde reactie is:
- Hierin is ATP: Adenosinetrifosfaat, ADP: Adenosinedifosfaat, Pi: Anorganisch fosfaat
Eerste stap van ammoniak naar nitriet:
- + energie (ΔG°' = −235 kJ/mol)
Hydroxylamine () is een intermediair in dit proces. De vorming van de waterstofionen geeft aan dat nitrificatie een verzurend proces is.
Tweede stap van nitriet naar nitraat:
- + energie (ΔG°' = −76 kJ/mol)
Totaalvergelijking:
- + energie
Soorten stikstofwortelknolletjes[2]
Onbepaalde stikstofwortelknolletjes
Onbepaalde stikstofwortelknolletjes komen bij de meeste peulvruchten van de onderfamilies, Caesalpinioideae, Faboideae en Mimosoideae voor, zowel in de gematigde gebieden als in de tropen. Ze komen voor bij de Faboideae, zoals Pisum (erwt), Medicago (lucerne), Trifolium (klaver) en Vicia (wikke en tuinboon) en alle Mimosoideae peulvruchten zoals acacia's en de Caesalpinioideae, zoals Chamaecrista fasciculata. Ze worden "onbepaald" genoemd, omdat ze een actief apicaal meristeem hebben, dat nieuwe cellen produceert gedurende de levensduur van het stikstofwortelknolletje. Hierdoor heeft het stikstofwortelknolletje meestal een cilindrische vorm met soms uitgebreide vertakkingen.[3] Doordat ze actief blijven groeien zijn er in het weefsel zone's te zien door de verschillende stadia van ontwikkeling/symbiose:[4][5][6]
- Zone I - het actieve meristeem. Dit is waar nieuw weefsel wordt gevormd, dat later zal differentiëren in de andere zones van het stikstofwortelknolletje.
- Zone II - de infectiezone. In deze zone komen infectiedraden vol met bacteriën voor. De plantencellen zijn groter dan in de vorige zone en de celdeling is gestopt.
- Interzone II – III — Hier zijn de bacteriën de plantencellen binnengedrongen, die amyloplasten bevatten. Ze verlengen en beginnen terminaal te differentiëren in symbiotische, stikstofbindende bacteriën.
- Zone III — de stikstofbindingszone. Elke cel in deze zone bevat een grote, centrale vacuole en het cytoplasma is gevuld met volledig gedifferentieerde bacteriën die actief de stikstof binden. De plant voorziet deze cellen van leghemoglobine, waardoor ze een opvallende roze kleur hebben.
- Zone IV — de verouderingszone. Hier worden plantencellen met hun bacteriën afgebroken. De verdeling van de heemcomponent van leghemoglobine resulteert in een zichtbare vergroening aan de basis van het stikstofwortelknolletje. Dit is het meest bestudeerde type stikstofwortelknolletje, maar de details zijn behoorlijk verschillend tussen stikstofwortelknolletje van pinda en verwanten en sommige andere belangrijke gewassen zoals lupines waar het stikstofwortelknolletje gevormd wordt direct nadat de Rhizobium-bacterie via de rhizodermis de plant is binnengedrongen en waarbij geen infectiedraden worden gevormd. Deze stikstofwortelknolletjes groeien rond de wortel en vormen een kraagachtige structuur. In deze stikstofwortelknolletjes en in het pindatype is het centrum van het geïnfecteerde weefsel uniform, waarbij niet-geïnfecteerde cellen ontbreken, maar die wel worden gevonden in stikstofwortelknolletjes van sojabonen en vele andere soorten zoals erwten en klavers.
-
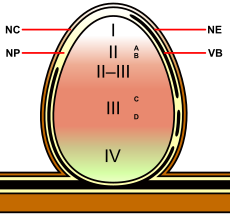 Diagram met de verschillende zones van een onbepaald stikstofwortelknolletje (zie tekst).
Diagram met de verschillende zones van een onbepaald stikstofwortelknolletje (zie tekst). -
 De verschillende zones bij Medicago, geïnoculeerd met Sinorhizobium meliloti
De verschillende zones bij Medicago, geïnoculeerd met Sinorhizobium meliloti - Roze stikstofwortelknolletjes bij witte klaver
Bepaalde stikstofwortelknolletjes
Bepaalde stikstofwortelknolletjes komen voor bij bepaalde tropische peulvruchten zoals die van de geslachten Glycine (sojaboon), Phaseolus (boon) en Vigna en op sommige peulvruchten in de gematigde gebieden zoals Lotus. Deze stikstofwortelknolletjes stoppen kort na het binnendringen van de bacterie in de wortel de celdeling van het apicale meristeem. Het stikstofwortelknolletje wordt groter door de toename van de celgrootte, waardoor deze bolvormig wordt. Een ander type van bepaalde stikstofwortelknolletjes is te vinden bij een breed scala aan kruiden, struiken en bomen, zoals Arachis (pinda). Deze komen altijd voor in de oksels van zij- of adventieve wortels doordat de bacteriën via scheurtjes ontstaan door de zij- of adventieve wortelvorming de wortels binnendringen. Ze dringen niet de wortelharen binnen. Hun interne structuur is daardoor heel anders dan die van het onbepaalde stikstofwortelknolletje.[3]
Knolletjesvorming

Peulvruchten vormen flavonoïden (secundaire metabolieten), die via de wortels worden uitgescheiden. Ze trekken de Rhizobium-bacteriën aan en zetten ook de nod-genen (nod=nodulation=knolletjesvorming) in de bacteriën aan tot het produceren van nod-factoren, die de vorming van stikstofwortelknolletjes initiëren.[7][8] Deze nod-factoren zorgen ervoor dat de wortelhaar gaat krullen. Het krullen begint aan de top van de wortelhaar dat zich vervolgens rond de Rhizobium-bacterie krult. Binnen de worteltop vormt zich een buisje, de infectiedraad, waardoor de Rhizobium-bacterie de rhizodermiscellen van de wortel binnendringt, terwijl de wortelhaar verder doorkrult.[9]
Gedeeltelijke krulling kan zelfs worden bereikt door de nod-factor alleen.[8] Dit werd aangetoond door de isolatie van de nod-factoren en deze in contact te brengen met de wortelhaar. De wortelharen krulden in de richting van de nod-factor en lieten de werking van een wortelhaar zien, die zich rond een bacterie probeerde te krullen. Zelfs toepassing op zijwortels veroorzaakte krulling. Dit toonde aan dat het de nod-factor zelf is en niet de bacterie die de krulling veroorzaakt.[8]
Wanneer de nod-factor door de wortel wordt opgemerkt, treden er een aantal biochemische en morfologische veranderingen op: de celdeling in de wortel wordt geactiveerd om het stikstofwortelknolletje te maken en de wortelhaar groeit meerdere keren rond de bacteriën, totdat het een of meer bacteriën volledig heeft ingekapseld. De ingekapselde bacteriën delen zich meerdere keren en vormen een microkolonie. Vanuit deze microkolonie gaan de bacteriën de rhizodermiscellen van het zich ontwikkelende stikstofwortelknolletje via de infectiedraad in de top van de wortelhaar binnen. Vervolgens gaan ze verder de wortelcortex in en worden ze omringd door een door de plant gemaakt symbiosoommembraan en veranderen ze in bacteriën die de luchtstikstof kunnen vastleggen.[10]
Ongeveer vier weken na het zaaien van het gewas beginnen de stikstofwortelknolletjes zich te ontwikkelen, waarbij de grootte en vorm van de stikstofwortelknolletjes afhankelijk is van het gewas. Gewassen zoals sojabonen of pinda's hebben grotere stikstofwortelknolletjes dan voedergewassen zoals rode klaver of lucerne, omdat hun stikstofbehoefte groter is. Het aantal stikstofwortelknolletjes en de inwendige kleur geven de staat van stikstofbinding in de plant aan.[11]
De vorming van het stikstofwortelknolletje wordt beïnvloed door uitwendige omstandigheden, zoals temperatuur, zuurgehalte grond, droogte en nitraatgehalte en door inwendige omstandigheden zoals autoregulatie en ethyleen. De autoregulatie[12] regelt het aantal stikstofwortelknolletje per plant via een systemisch proces waarbij het blad betrokken is. Het bladweefsel neemt het begin van de vorming van de stikstofwortelknolletjes in de wortel waar door een onbekend chemisch signaal en beperkt dan de verdere ontwikkeling van het stikstofwortelknolletje in nieuw gevormd wortelweefsel. De leucine rich repeat (LRR) receptorkinasen (NARK in sojabonen; HAR1 in Lotus japonicus en SUNN in Medicago truncatula) zijn noodzakelijk voor de autoregulatie bij de vorming van het stikstofwortelknolletje (AON). Mutatie die leidt tot functieverlies van deze AON-receptorkinasen leidt tot super- of hyper-vorming. Vaak gaan afwijkingen van de wortelgroei gepaard met het verlies van AON-receptorkinase-activiteit, wat suggereert dat de groei van het stikstofwortelknolletje en de wortelontwikkeling functioneel gekoppeld zijn. Onderzoek naar de mechanismen van de vorming van een stikstofwortelknolletje toonde aan dat het ENOD40-gen, coderend voor een eiwit en dat 12-13 aminozuren lang is, tijdens de vorming van het stikstofwortelknolletje actiever wordt. De vorming en functie van stikstofwortelknolleltjes wordt sterk geremd door toevoeging van ethyleen. De vorming van stikstofwortelknolletjes door Rhizoium meliloti bij Medicago sativa werd tweevoudig gestimuleerd wanneer de ethyleen biosynthese-remmer amino-ethoxyvinylglycine (AVG) werd toegevoegd aan het inoculum.[13]
Niet-vlinderbloemigen

Stikstofwortelknolleltjes die voorkomen op niet-vlinderbloemigen, zoals bij Trema-soorten met Rhizobium-bacteriën en Alnus-soorten met Frankia alni verschillen aanzienlijk van die gevormd bij de vlinderbloemigen. In deze symbiose komen de bacteriën nooit via de infectiedraad binnen. Frankia-bacteriesoorten komen bij ongeveer tweehonderd niet-vlinderbloemige soorten voor in volgorde van belangrijkheid zijn dat (families tussen haakjes): Cucurbitales (Coriariaceae en Datiscaceae), Fagales (Betulaceae, Casuarinaceae en Myricaceae), Rosales (Rhamnaceae, Elaeagnaceae en Rosaceae).[14] De totale omvang van de symbiose bij niet-vlinderbloemigen is vergelijkbaar met die bij de vlinderbloemigen.[14] Al deze ordes plus de Fabales vormen een enkele stikstofbindende clade binnen de bredere clade van Rosids.
Sommige schimmels produceren knolvormige structuren bekend als knolvormige ectomycorrhiza's op de wortels van hun gastheer. Suillus tomentosus, bijvoorbeeld, produceert deze structuren bij zijn gastheer Pinus contorta var. latifolia. Deze structuren bevatten stikstofbindende bacteriën, die een aanzienlijke hoeveelheid stikstof beschikbaar maken voor hun gastheer, waardoor de draaidennen ook op stikstofarme gronden kunnen groeien.[15]
Bronnen, noten en/of referenties
|



















