Ácido nitroso
| Ácido Nitroso Alerta sobre risco à saúde | |
|---|---|
 | |
| Identificadores | |
| Número CAS | 7782-77-6 |
| Propriedades | |
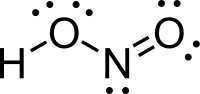
| Fórmula química | HNO2 |
| Massa molar | 47 g mol-1 |
| Aparência | Solução pálida azul |
| Densidade | Aprox. 1 g/ml |
| Acidez (pKa) | 3.398 |
| Riscos associados | |
| Ponto de fulgor | Non-flammable |
| Compostos relacionados | |
| Outros aniões/ânions | Ácido nítrico |
| Outros catiões/cátions | Nitrito de sódio Nitrito de potássio Nitrito de amônia |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Ácido Nitroso é um ácido do nitrogênio cujo estado de oxidação é +3. Tem fórmula química HNO2. É formado por um átomo de Hidrogênio, um de Nitrogênio e dois de Oxigênio. Sua massa molecular pode ser calculada pela soma das massas atômicas de seus elementos 1+14+(16x2)=47.(Dioxonítrico)[1]
Estrutura
Na fase gasosa, a molécula de ácido nitroso planar pode adoptar um tanto na forma cis e trans. A forma trans predomina em temperatura ambiente, e indicadores medições em Infravermenho de estabilidade por volta de .[2]
-
 dimensões da forma trans (a partir do espectro de microondas).
dimensões da forma trans (a partir do espectro de microondas). -
 modelo da 'forma' 'trans'.
modelo da 'forma' 'trans'. -
 Forma cis.
Forma cis.
Classificação
É oxiácido, é considerado médio, seu grau de ionização é igual 0,08. Este monoácido ou monoprotônico possui um alto grau de reversibilidade, pois de cada 100 moléculas dissolvidas, 92 se regeneram e apenas 8 se ionizam. É um ácido ternário, inorgânico e instável.
Reação de dissociação eletrolítica do ácido nitroso
Este ácido se dissolve facilmente em água, conforme a propriedade, produzindo o cátion Hidrônio ou Hidroxônio . O desenho mostra o hidrogênio do ácido ao lado de um dos pares eletrônicos do oxigênio da água. Observe que é o próton do hidrogênio que se desloca emprestando assim sua carga positiva, e seu elétron foi deixado no ânion de onde advém a sua carga negativa: pode-se dizer que o núcleo do átomo de hidrogênio foi separado de seu elétron. Esta reação é comum a todos os ácidos e o ânion nitrito pode ser representado assim.
O desenho ao lado é um demonstrativo do que foi explicado, a migração do hidrogênio até o par eletrônico da água. A água tem uma natureza polar por isso facilmente atrai o próton do hidrogêno.
Processos de obtenção do ácido nitroso
Conforme diversos autores de livros de química, dentre eles destacam-se Química Geral de Linus Pauling, destacam-se três processos comuns de laboratório para obtenção do ácido nitroso.
Primeiro processo
Dissolvendo-se Dióxido de Nitrogênio em água, formam-se dois ácidos simultaneamente, ácido nítrico e ácido nitroso que podem ser separados facilmente pela adição de um álcalino, conforme a reação abaixo
Segundo processo
Decomposição térmica dos nitratos em nitritos. Podem-se usar mais facilmente os nitratos de sódio ou potássio, obtendo-se nitritos correspondentes.
Terceiro processo
Redução de nitratos pelo chumbo. Os sais produzidos têm uma coloração amarelo-pálida, embora suas soluções sejam amarelo mais intenso.
Propriedades do ácido nitroso
Entre as propriedades mais comuns podemos citar
Reação de salificação do ácido nitroso
Todo ácido, quando em presença de uma base, produz sal e água. Esta propriedade é comum a todos os ácidos. A reação pode ser representada assim
Reação com as aminas
Estas reações servem como método de identificação das aminas.[1]
- Aminas não aromáticas
- Estas aminas reagem com o ácido nitroso formando um álcool, água e gás nitrogênio, que se desprende em forma de bolhas.
- Aminas aromáticas
- As aminas aromáticas em presença do ácido nitroso produzem nitroso-aminas e água. É seguro dizer que as aminas secundárias não aromáticas têm um comportamento idêntico.

Ver também
Referências
Bibliografia
- Michael M. Cox | Jennifer A. Doudna | Michael O’Donnell, Biologia Molecular: Princípios e Técnicas; Artmed, 2012, ISBN 8-536-32741-3
- Academia das Ciências de Lisboa, Jornal de sciencias mathematicas, physicas e naturaes, Oxford University , ISBN 1-113-43598-4 ISBN 1-140-43346-6 (em inglês)
- Gerard J. Tortora | Berdell R. Funke | Christine L. Case , Microbiologia , Artmed, 2012 ISBN 8-536-32698-0
- United States Coast Guard, Regia Officina Typografica , Pharmacopeia Geral Para O Reino O Dominios de Portugal; Tomo II, Medicamentos Simplices, Preparados E Compostos Paperback, ISBN 1-155-07214-6 (em inglês)
- Peter Vollhardt, Neil E. Schore, Química Orgânica - 6.ed.: Estrutura e Função , Bookman Editora, 2013 ISBN 8-565-83732-7
- Arnaldo Zaha, Henrique Bunselmeyer Ferreira, Luciane M. P. Passaglia, Biologia Molecular Básica - 5.ed. , Artmed Editora, 2014 ISBN 8-582-71058-5
- Grupo de Pesquisa em Educacao Quimica , Interações e Transformações: Professor - A Química e a Sobrevivência - Atmosfera/Fonte de Materiais Vol. 3, EdUSP ISBN 8-531-40718-4
- Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry, 3rd Edition. Pearson. ISBN 978-0-13-175553-6. (em inglês)
- Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995. ISBN 0-309-05229-7. (em inglês)
 | Este artigo sobre um composto inorgânico é um esboço. Você pode ajudar a Wikipédia expandindo-o. |
 Portal da química
Portal da química

























