Dissulfeto
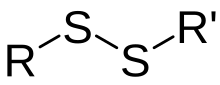
Em química, um dissulfeto usualmente refere-se a unidade estrutural composta de um par ligado de átomos de enxofre. O ânion dissulfeto é S22−. O termo dissulfeto pode também referir-se a um composto químico que contém uma centro dissulfeto, tal como o dissulfeto de difenila, C6H5S-SC6H5.
Dissulfetos inorgânicos vs. orgânicos
O ânion dissulfeto é S22−, ou −S–S−. Ao enxofre é usualmente atribuído o número de oxidação reduzido −2, descrito como S2− e chamado sulfeto. Tem a configuração de elétrons de um gás nobre (argônio). No dissulfeto, enxofre é somente reduzido a um estado com número de oxidação −1. Sua configuração então se assemelha ao de um átomo de cloro. Portanto, tende a formar uma ligação covalente com um outro centro S− para formar um grupo S22−. Oxigênio também comporta-se similarmente, e.g. em peróxidos tais como H2O2. Exemplos:
- Dissulfeto de ferro (FeS2), e.g. o mineral pirita.
- Dicloreto de dienxofre (S2Cl2), um líquido destilável.
Em muitos casos, cada um dos átomos de enxofre em um grupo dissulfeto é ligado covalentemente a um átomo de carbono em um composto orgânico, formando uma ligação dissulfeto, algumas vezes chamada uma ponte dissulfeto ou conexão dissulfeto. Exemplos:
 |  |  |  |  |
Dissulfetos covalentes
Dissulfetos covalentes, também chamados disulfanos, tem a fórmula geral R1-S-S-R2. Para dissulfetos simétricos tem-se R1=R2, para dissulfetos assimétricos os radicais orgânicos R1 e R2 diferem. Com baixo peso molecular dissulfetos orgânicos são apolares, voláteis e substâncias de cheiro desagradável. O representante mais simples desta classe de compostos é dissulfureto de dimetilo. Sabe-se que o alho e cebola possuem odor característico causado pelo dissulfeto de dialilo.[1] Dissulfetos orgânicos com maior massa molar são inodoros.
Ocorrência na natureza
Pontes de dissulfeto em unidades de cistina de proteínas (insulina, queratina, oxitocina, etc) desempenham um papel importante na estrutura terciária. Além disso, a estrutura de dissulfeto é encontrada em produtos naturais heterocíclicos, tais como (+)-ácido lipóico e ácido asparagúsico.[1]
Nomenclaturas impróprias
Dissulfeto é também utilizado para se referir a compostos que contêm dois centros sulfeto de (S2−). O composto de dissulfeto de carbono, CS2 é descrito com a fórmula estrutural i.e. S=C=S. Esta molécula não é um dissulfeto no sentido de que lhe falta uma ligação S-S. Do mesmo modo, dissulfeto de molibdénio, MoS2, não é um dissulfeto no sentido mais uma vez de que os seus átomos de enxofre não estão ligados.
 |  |
Exemplos
- Dissulfeto de ferro (FeS2)
- Cistina (aminoácido)
- Proteínas (contém ponte dissulfeto)
Referências
Ver também
- Peróxidos - R-O-O-R'
 | Este artigo sobre Química é um esboço. Você pode ajudar a Wikipédia expandindo-o. |











