Tiocijanat
| Tiocijanat | |||
|---|---|---|---|
 | |||
| IUPAC ime |
| ||
| Drugi nazivi | sulfocijanat, tiocijanid | ||
| Identifikacija | |||
| PubChem[1][2] | 9322 | ||
| ChemSpider[3] | 8961  Y Y | ||
| ChEBI | 18022 | ||
| ChEMBL[4] | CHEMBL84336  Y Y | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | SCN- | ||
| Molarna masa | 58,0824 | ||
| Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Tiocijanat ili rodanid je anjon [SCN]−. On je konjugovana baza tiocijanske kiseline. Primeri jedinjenja sa ovom grupom su bezbojne soli kalijum tiocijanat i natrijum tiocijanat. Živa(II) tiocijanat je nekad korištena u pirotehničkim smesama. Organska jedinjenja koja sadrže ovu funkcionalnu grupu se takođe nazivaju tiocijanatima.
Tiocijanat je analogan cijanatnom jonu, [OCN]−, kiseonik je zamenjen sumporom. [SCN]− je jedan od pseudohalida, u smislu sličnosti njegovih reakcija sa halidnim jonima. Tiocijanat se formira reakcijom elementarnog sumpora ili tiosulfata sa cijanidom:
- 8 CN− + S8 → 8 SCN−
- CN− + S2O32− → SCN− + SO32−
Drugu reakciju katalizuje enzim sulfotransferaza, poznat kao rodanaza. Ta reakcija je relevantna za detoksifikaciju cijanida u telu.
Struktura, vezivanje i koordinaciona hemija
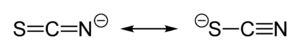
Tiocijanat aproksimativno jednako deli svoje negativno naelektrisanje između sumpora i azota. Konsekventno, tiocijanat može da deluje kao nukleofil na bilo sumporu ili azotu. [SCN]− takođe može da premoštava (M−SCN−M) ili čak tri metala (>SCN− ili −SCN<). Eksperimentalna evidencija dovodi do opštog zaključka da klasa A metala teži da formira N-vezane tiocijanatne komplekse, dok metali klase B formiraju S-vezane tiocijanatne komplekse. Drugi faktori, e.g. kinetika i rastvorljivost, ponekad imaju uticaja, te dolazi do izomerizma veza, na primer [Co(NH3)5(NCS)]Cl2 i [Co(NH3)5(SCN)]Cl2.[5]
Organski tiocijanati
Tiocijanatni derivati organiskih jedinjenja i prelaznih metala mogu da postoje kao izomeri veza. U tiocijanatima, organska grupa (ili metalni jon) je vezan za sumpor: R−S−C≡N ima S-C jednostruku vezu i C-N trostruku vezu.[6] U izotiocijanatima, supstituent je vezan za azot: R−N=C=S ima S-C dvostruku vezu i C-N dvostruku vezu:
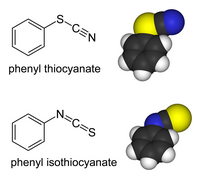
Feniltiocijanat i fenilizotiocijanat su izomerno vezani
Organski tiocijanati se mogu hidrolizovati do tiokarbamata.[7][8]
Reference
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519. edit
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846. edit
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594. edit
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd izd.). Oxford: Butterworth-Heinemann. str. 326. ISBN 0080379419.
- ↑ Guy, R. G. (1977). „Syntheses and Preparative Applications of Thiocyanates”. u: Patai, S.. Chemistry of Cyanates and Their Derivatives. 2. New York: John Wiley.
- ↑ Randolph Riemschneider, G. Orlick (1952). „Die Schmelzpunkte primärer Monothiocarbamidsäure-S-n-alkyl-ester Thiocarbamate. VI. Mitteilung”. Angewandte Chemie 64 (15): 429. DOI:10.1002/ange.19520641506.
- ↑ R. Riemschneider, F. Wojahn, and G. Orlick (1951). „Thiocarbamates. III.1 Aryl Thiocarbamates from Aryl Thiocyanates”. Journal of the American Chemical Society 73 (12): 5905–5907. DOI:10.1021/ja01156a552.
Literatura
Spoljašnje veze
 | Portal Hemija |
- p
- r
- u
Alkohol • Aldehid • Alkan • Alken • Alkin • Amid • Amidin • Amin • Azo jedinjenje • Derivat benzena • Karboksil • Cijanat • Disulfid • Estar • Etar • Haloalkan • Hidrazon • Imid • Imin • Izocijanid • Izocijanat • Izonitril • Izotiocijanat • Karbamat • Keton • Organofosfor • Oksim • Nitril • Nitro • Nitrozo • Peroksid • Fosfonit • Fosfonat • Derivat piridina • Sulfon • Sulfonska kiselina • Sulfoksid • Tiocijanat • Tioestar • Tioetar • Tiol










