Salpetersyrlighet
| Salpetersyrlighet | |
  | |
| Systematiskt namn | Kväve(III)syra |
|---|---|
| Övriga namn | Vätenitrit |
| Kemisk formel | HNO2 |
| Molmassa | 47,013 g/mol |
| Utseende | Svagt blåaktig lösning |
| CAS-nummer | 7782-77-6 |
| SMILES | ON=O |
| Faror | |
| Huvudfara |  Frätande Frätande |
| SI-enheter & STP används om ej annat angivits | |
Salpetersyrlighet (HNO2) är en relativt svag syra, nära besläktad med salpetersyra, men mycket svagare (pKa = 3,398). Salterna av salpetersyrlighet kallas nitriter.
Framställning
Salpetersyrlighet bildas i naturen då kvävemonoxid (NO) och kvävedioxid (NO2) reagerar med vatten.
Industriellt framställs salpetersyrlighet genom att lösa upp natriumnitrit i godtycklig mineralsyra.
Egenskaper
Syran kan inte koncentreras utan sönderfaller i kväveoxider (NOx), vatten, lustgas (N2O) och salpetersyra (HNO3).
Struktur
Salpetersyrlighet har en plan molekylstruktur som kan anta både en cis- och en trans-form. Trans-formen dominerar vid rumstemperatur och den har ca 2,3 kJ/mol lägre tillståndsenergi.
-
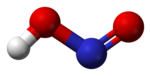 Molekylmodell av trans-formen.
Molekylmodell av trans-formen. -
 Molekylmodell av cis-formen.
Molekylmodell av cis-formen.















