1,2-difluorethaan
| 1,2-difluorethaan | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
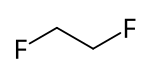 | |||||
 | |||||
| Algemeen | |||||
| Molecuulformule | |||||
| IUPAC-naam | 1,2-Difluorethaan | ||||
| Andere namen | HFC-152 | ||||
| Molmassa | 66,051 g/mol | ||||
| SMILES | C(CF)F | ||||
| CAS-nummer | 624-72-6 | ||||
| PubChem | 12223 | ||||
| Wikidata | Q27254799 | ||||
| Beschrijving | kleurloze vloeistof | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H224 - H301+H311 - H315 - H319 - H330 - H335 | ||||
| P-zinnen | P210 - P233 - P240 - P241 - P242 - P243 - P260 - P264 - P270 - P271 - P280 - P284 - P301+P310 - P302+P352 - P303+P361+P353 - P304+P340 - P305+P351+P338 - P310 - P320 - P321 | ||||
| Fysische eigenschappen | |||||
| Dichtheid | 0,913 g/cm³ | ||||
| Smeltpunt | [2] −104 °C | ||||
| Kookpunt | 30,7 °C | ||||
| Oplosbaarheid in water | 2,31 g/L | ||||
| Goed oplosbaar in | ether, benzeen, chloroform | ||||
| log(Pow) | 1,21 | ||||
| Brekingsindex | 1,28 | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
1,2-difluoroethaan is een verzadigde fluorkoolwaterstof, waarbij elk van de twee koolstof-atomen een fluor-atoom draagt. De molecuulformule is , of met meer nadruk op de structuur: . Het is een isomeer van 1,1-difluorethaan. Het heeft de HFC-codering "HFC-152" zonder toevoeging van een letter.[3] Als de vloeistof wordt afgekoeld tot in de buurt van het stolpunt, kan het in twee verschillende conformeren voorkomen: gauche en trans.[4] In de vloeistof komen beide vormen in ongeveer gelijke hoeveelheden voor en gaan ze makkelijk in elkaar over. In de gasfase komt het molecuul voornamelijk voor in de gauche-vorm.[5]
In de HFC-152 codering staat de 2 voor de twee fluoratomen, de 5 betekent 5−1=4 waterstofatomen en de 1 staat voor 1+1=2 koolstofatomen.[6]
Synthese
Etheen reageert explosief met fluorgas waarbij een mengsel ontstaat van 1,2-difluorethaan en vinylfluoride. Met vaste fluor reageert etheen onder invloed van infrarood licht.[7]
Eigenschappen

De kritische temperatuur van de verbinding is 107,5 °C.[2]
Als een van de C-H bindingen te hoog aangeslagen is (te veel trillingen) dan is de intramoleculaire relaxatietijd 490 ps.[8]
De tweevlakshoek voor de F-C-C-F binding is, afhankelijk van de meetmethode, 68°.[9] of 72°.[10] Theoretische berekeningen geven ook aan dat de gauche-conformatie stabieler zal zijn ten gevolge van hyper-conjugatie. Omdat fluor veel elektronegatiever is dan koolstof, zal de bijdrage van fluor aan de bindende orbitaal veel groter zijn dan die van koolstof, wat omgekeerd betekent dat de antibindende orbitaal op koolstof belangrijker is. Deze orbitaal wordt via hyperconjugatie vanuit de C-H bindingen gestabiliseerd. De resulterende tweevlakshoek is de evenwichtswaarde van de tegengestelde effecten: hyperconjugatie en sterische hindering.[11]
Reacties
Onder invloed van licht reageert 1,2-difluorethaan met chloorgas. Er wordt een productenmengsel gevormd waarvan de relatieve hoeveelheden door het gebruikt oplosmiddel bepaald worden:[3]
Toepassingen
1,2-difluorethaan wordt in de VS vooral toegepast als koelvloeistaf (39%); schuimvormer (17%); oplosmiddel (14%); als uitgangsstof voor fluorpolymeren (14%); sterilisatiegas (2%); drijfgas in spuitbussen (2%); koelmiddel voor voedsel (1%); andere toepassingen (8%); het resterende deel wordt geëxporteerd.[12]
Veiligheid
1,2-difluorethaan is toxisch bij inademen of direct contact met de huid. Fluorkoolwaterstoffen zijn zwaarder dan lucht (voor deze verbinding iets meer dan twee keer zo zwaar) zodat ze de neiging zullen hebben zich in laag liggende delen van een ruimte op te hopen. Dit verhoogt het risico van inademing. 1,2-difluorethaan is voor mensen op verschillende manieren toxisch: Ten eerst kan het door zijn hoge dichtheid lucht (zuurstof) uit de longen verdringen, wat verstikkingsgevaar oplevert. Daarnaast verhogen ingeademde fluorkoolsofverbindingen de gevoeligheid van de hartspier voor catecholamines, wat resulteert in (dodelijke) hartritmestoornissen.[13]
Als de stof ingeademd wordt door ratten, wordt ze met behulp van cytochroom P450 omgezet in fluoracetaat en dan tot fluorcitraat. Beide verbindingen zijn toxisch. 100 ppm in de ademlucht was voldoende om de ratten in 30 minuten te vergiftigen en in 4 uur te doden. Vermoed wordt dat 1,2-difluorethaan voor mensen op dezelfde manier toxisch is.[14]
1,2-difluorethaan in het milieu
1,2-difluorethaan kan op verschillende manieren in het milieu terechtkomen. Als de stof in het oppervlaktewater terecht komt, kan ze verdampen. Geschat wordt dat de halveringstijd voor rivieren ongeveer 2,5 uur is, voor meren iets meer dan 3 dagen.[12] Uiteindelijk betekent het dat vrijgekomen 1,2-difluorethaan in de atmosfeer terecht komt. Daarin wordt het afgebroken door hydroxylradicalen en zuurstof.[15]
- dit is een peroxy-radicaal
In aanwezigheid van chloor-atomen, die als katalysator werken, en met stikstofoxides als oxidator wordt formylfluoride gevormd, dat uiteindelijk in waterstoffluoride en koolstofmonoxide uiteenvalt.[15]
In lucht ligt de halveringstijd tussen de 140 en 180 dagen.[12]
Controle
1,2-difluorethaan is een broeikasgas als het in de atmosfeer terecht komt. Het heeft een opwarmingscapaciteit die 140 keer groter is dan die van kooldioxide. Als zodanig is de stof onderhevig aan wettelijke regelgeving en bepalingen.[16]
Bronnen, noten en/of referenties
|






![{\displaystyle {\ce {CH2F-CH2F + Cl2 ->[{\ce {licht}}] CHClF-CHClF + CH2F-CCl2F}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7db6cac8bb8319acab0e12b6c06848d509fe885e)








