| ADAM10 |
|---|
 |
| Доступные структуры |
|---|
| PDB | Поиск ортологов: PDBe RCSB |
|---|
| Список идентификаторов PDB |
|---|
1M1I |
|
|
| Идентификаторы |
|---|
| Псевдонимы | ADAM10, AD10, AD18, CD156c, HsT18717, MADM, RAK, kuz, CDw156, ADAM metallopeptidase domain 10 |
|---|
| Внешние ID | OMIM: 602192 MGI: 109548 HomoloGene: 865 GeneCards: ADAM10 |
|---|
|
|
| Паттерн экспрессии РНК |
|---|
| Bgee | | Человек | Мышь (ортолог) |
|---|
| Наибольшая экспрессия в | - stromal cell of endometrium
- visceral pleura
- trigeminal ganglion
|
| | Наибольшая экспрессия в | - cumulus cell
- mucous cell of stomach
- left lung lobe
- conjunctival fornix
- medullary collecting duct
|
| | Дополнительные справочные данные |
|
|---|
| BioGPS | 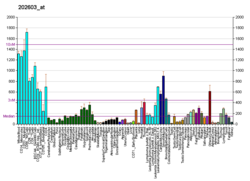

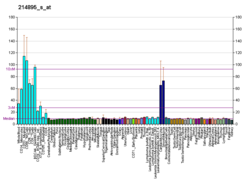 | | Дополнительные справочные данные |
|
|---|
|
| Генная онтология |
|---|
| Молекулярная функция | - гомодимеризация белка
- SH3 domain binding
- endopeptidase activity
- связывание с ионом металла
- integrin binding
- peptidase activity
- связывание с белками плазмы
- signaling receptor binding
- гидролазная активность
- protein kinase binding
- metallopeptidase activity
- metalloendopeptidase activity
| | Компонент клетки | - цитоплазма
- часть мембраны
- мембрана
- постсинаптическое уплотнение
- фокальные контакты
- клеточная мембрана
- perinuclear endoplasmic reticulum
- Golgi-associated vesicle
- tetraspanin-enriched microdomain
- экзосома
- клеточное ядро
- поверхность клетки
- Golgi membrane
- внеклеточное пространство
- аппарат Гольджи
- specific granule membrane
- tertiary granule membrane
- endoplasmic reticulum lumen
- trans-Golgi network
- синаптический пузырёк
- дендрит
- neuronal cell body
- дендритный шипик
- postsynaptic membrane
- постсинапс
- glutamatergic synapse
| | Биологический процесс | - Notch signaling pathway
- positive regulation of cell migration
- ephrin receptor signaling pathway
- передача сигнала между клетками
- constitutive protein ectodomain proteolysis
- protein processing
- extracellular matrix disassembly
- in utero embryonic development
- протеолиз
- monocyte activation
- response to tumor necrosis factor
- фосфорилация белка
- positive regulation of cell growth
- positive regulation of T cell chemotaxis
- позитивная регуляция пролиферации клеток
- Notch receptor processing
- integrin-mediated signaling pathway
- membrane protein ectodomain proteolysis
- negative regulation of cell adhesion
- neutrophil degranulation
- посттрансляционная модификация
- Сперматогенез
- amyloid-beta formation
- Notch receptor processing, ligand-dependent
- positive regulation of apoptotic process
- regulation of dendritic spine morphogenesis
- response to antineoplastic agent
- regulation of neurotransmitter receptor localization to postsynaptic specialization membrane
- postsynapse organization
| | Источники: Amigo, QuickGO |
|
| Ортологи |
|---|
| Вид | Человек | Мышь |
|---|
| Entrez | | |
|---|
| Ensembl | | |
|---|
| UniProt | | |
|---|
| RefSeq (мРНК) | | |
|---|
| RefSeq (белок) | |
|---|
NP_001101
NP_001307499
NP_001101.1 |
| |
|---|
| Локус (UCSC) | Chr 15: 58.59 – 58.75 Mb | Chr 9: 70.59 – 70.69 Mb |
|---|
| Поиск по PubMed | Искать[3] | Искать[4] |
|---|
|
 Информация в Викиданных Информация в Викиданных |
| Смотреть (человек) | Смотреть (мышь) |
|
ADAM10 (CD156c; англ. A Disintegrin And Metalloproteinase domain 10; КФ: 3.4.24.81) — фермент металлопротеаза, относящийся к семейству металлопротеаз ADAM. Играет важную роль в развитии, воспалении, нейропротекции и онкологических заболеваниях. По ферментативной специфичности близка к другой металлопротеазе ADAM17.
Структура
С помощью метода кристаллографического анализа дифракции рентгеновских лучей была изучена структура одного домена ADAM10. Богатый цистеином домен играет важную роль в регуляции активности протеаз in vivo. Недавние экспериментальные данные свидетельствуют о том, что эта область, отличная от активного центра, может быть ответственна за субстратную специфичность фермента. Предполагается, что этот домен связывается с определенными областями субстрата и фермента, позволяя происходить гидролизу пептидных связей в четко определенных участках субстрата[5].
Предлагаемый активный центр ADAM10 идентичен ферментам в семействе металлопротеиновых белков змеиного яда. Структурный анализ ADAM17 показал, что он имеет ту же последовательность аминокислот активного центра, что и ADAM10, и это позволяет предположить, что три гистидина в этой последовательности связывают атом Zn2+, а глутамат является каталитически активным участком[6].
Функции
ADAM10 представляет собой металлопротеазу с относительно низкой специфичностью, локализованную на поверхности клеток и способную расщеплять широкий спектр белков. В нейронах ADAM10 является наиболее важным ферментом для протеолитического процессинга белка-предшественника амилоида. ADAM10 вместе с ADAM17 расщепляет эктодомен триггерного рецептора, экспрессируемого на миелоидных клетках — TREM2, с образованием растворимого sTREM2, который был предложен в качестве биомаркера при нейродегенеративных заболеваниях. ADAM10 принадлежит к подсемейству металлопротеаз A, самому древнему подсемейству белков ADAM, которое является общим для всех основных групп животных, хоанофлагеллят, грибов и зелёных водорослей из класса Mamiellophyceae.
Субстраты
К субстратам ADAM10 относятся ряд молекул адгезии, находящиеся на клеточной мембране, включая L1-CAM, E-кадгерин, N-кадгерин и CD44.[7][8]
Клиническое значение
Заболевания головного мозга
ADAM10 играет ключевую роль в регуляции молекулярных механизмов, ответственных за формирование, созревание и стабилизацию дендритных шипов, а также в молекулярной организации глутаматергических синапсов. Следовательно, изменение активности ADAM10 строго коррелирует с возникновением различных типов синаптопатий, начиная от нарушений развития нервной системы, то есть расстройств типа аутизма, и заканчивая нейродегенеративными заболеваниями, типа болезни Альцгеймера[9].
Рак молочной железы
В сочетании с низкими дозами герцептина — противоопухолевыми антителами — селективные ингибиторы ADAM10 снижают пролиферацию в клеточных линиях со повышенной экспрессией HER2, в то время как ингибиторы, которые не ингибируют ADAM10, не действуют. Эти результаты согласуются с тем, что ADAM10 является основным фактором контроля HER2, ингибирование которого может обеспечить новый терапевтический подход к лечению рака молочной железы и других видов рака с активной передачей сигналов HER2. Повышенное количество продукта гена ADAM10 в нейронных синапсах в сочетании с белком AP2 было отмечено в нейронах гиппокампа у пациентов с болезнью Альцгеймера[10].
Примечания
- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000137845 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000054693 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: (неопр.) Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: (неопр.) Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Smith KM, Gaultier A, Cousin H, Alfandari D, White JM, DeSimone DW (December 2002). "The cysteine-rich domain regulates ADAM protease function in vivo". The Journal of Cell Biology. 159 (5): 893—902. doi:10.1083/jcb.200206023. PMC 2173380. PMID 12460986.
- ↑ Wolfsberg TG, Primakoff P, Myles DG, White JM (October 1995). "ADAM, a novel family of membrane proteins containing A Disintegrin And Metalloprotease domain: multipotential functions in cell-cell and cell-matrix interactions". The Journal of Cell Biology. 131 (2): 275—8. doi:10.1083/jcb.131.2.275. PMC 2199973. PMID 7593158.
- ↑ Lee S.B., Schramme A., Doberstein K., Dummer R., Abdel-Bakky M.S., Keller S., Altevogt P., Oh S.T., Reichrath J., Oxmann D., Pfeilschifter J., Mihic-Probst D., Gutwein P. ADAM10 is upregulated in melanoma metastasis compared with primary melanoma (англ.) // Journal of Investigative Dermatology[англ.] : journal. — 2010. — March (vol. 130, no. 3). — P. 763—773. — doi:10.1038/jid.2009.335. — PMID 19865098.
- ↑ Anderegg U., Eichenberg T., Parthaune T., Haiduk C., Saalbach A., Milkova L., Ludwig A., Grosche J., Averbeck M., Gebhardt C., Voelcker V., Sleeman J.P., Simon J.C. ADAM10 is the constitutive functional sheddase of CD44 in human melanoma cells (англ.) // Journal of Investigative Dermatology[англ.] : journal. — 2009. — June (vol. 129, no. 6). — P. 1471—1482. — doi:10.1038/jid.2008.323. — PMID 18971959.
- ↑ Marcello E, Borroni B, Pelucchi S, Gardoni F, Di Luca M (November 2017). "ADAM10 as a therapeutic target for brain diseases: from developmental disorders to Alzheimer's disease". Expert Opinion on Therapeutic Targets. 21 (11): 1017—1026. doi:10.1080/14728222.2017.1386176. PMID 28960088. S2CID 46800368.
- ↑ 'Sheddase' helps the malaria parasite invade red blood cells (неопр.). Архивировано из оригинала 12 апреля 2008 года.
Ссылки
- Pruessmeyer J., Ludwig A. The good, the bad and the ugly substrates for ADAM10 and ADAM17 in brain pathology, inflammation and cancer (англ.) // Seminars in Cell and Developmental Biology[англ.] : journal. — 2009. — April (vol. 20, no. 2). — P. 164—174. — doi:10.1016/j.semcdb.2008.09.005. — PMID 18951988.
- Crawford H.C., Dempsey P.J., Brown G., Adam L., Moss M.L. ADAM10 as a therapeutic target for cancer and inflammation (англ.) // Current Pharmaceutical Design[англ.] : journal. — 2009. — Vol. 15, no. 20. — P. 2288—2299. — PMID 19601831.
- Deuss M., Reiss K., Hartmann D. Part-time alpha-secretases: the functional biology of ADAM 9, 10 and 17 (англ.) // Current Alzheimer Research[англ.] : journal. — 2008. — April (vol. 5, no. 2). — P. 187—201. — PMID 18393804.
 |
|---|
| 1-50 | - CD1 (a-c, 1A, 1D, 1E)
- CD2
- CD3 (γ, δ, ε)
- CD4
- CD5
- CD6
- CD7
- CD8 (a)
- CD9
- CD10
- CD11 (a, b, c, d)
- CD13
- CD14
- CD15
- CD16 (A, B)
- CD18
- CD19
- CD20
- CD21
- CD22
- CD23
- CD24
- CD25
- CD26
- CD27
- CD28
- CD29
- CD30
- CD31
- CD32 (A, B)
- CD33
- CD34
- CD35
- CD36
- CD37
- CD38
- CD39
- CD40
- CD41
- CD42 (a, b, c, d)
- CD43
- CD44
- CD45
- CD46
- CD47
- CD48
- CD49 (a, b, c, d, e, f)
- CD50
|
|---|
| 51-100 | - CD51
- CD52
- CD53
- CD54
- CD55
- CD56
- CD57
- CD58
- CD59
- CD61
- CD62 (E, L, P)
- CD63
- CD64 (A, B, C)
- CD66 (a, b, c, d, e, f)
- CD68
- CD69
- CD70
- CD71
- CD72
- CD73
- CD74
- CD78
- CD79 (a, b)
- CD80
- CD81
- CD82
- CD83
- CD84
- CD85 (a, d, e, h, j, k)
- CD86
- CD87
- CD88
- CD89
- CD90
- CD91
- CD92
- CD93
- CD94
- CD95
- CD96
- CD97
- CD98
- CD99
- CD100
|
|---|
| 101-150 | |
|---|
| 151-200 | - CD151
- CD152
- CD153
- CD154
- CD155
- CD156 (a, b, c)
- CD157
- CD158 (a, d, e, i, k)
- CD159 (a, c)
- CD160
- CD161
- CD162
- CD163
- CD164
- CD166
- CD167 (a, b)
- CD168
- CD169
- CD170
- CD171
- CD172 (a, b, g)
- CD174
- CD177
- CD178
- CD179 (a, b)
- CD181
- CD182
- CD183
- CD184
- CD185
- CD186
- CD191
- CD192
- CD193
- CD194
- CD195
- CD196
- CD197
- CDw198
- CDw199
- CD200
|
|---|
| 201-250 | |
|---|
| 251-300 | |
|---|
| 301-350 | |
|---|
| 351-400 | |
|---|

 Информация в Викиданных
Информация в Викиданных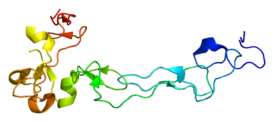
 Информация в Викиданных ?
Информация в Викиданных ?

















